Continua após a publicidade..
A figura representa uma amostra de um gás, suposto ideal, contida dentro de um cilindro. As paredes laterais e o êmbolo são adiabáticos; a base é diatérmica e está apoiada em uma fonte de calor.
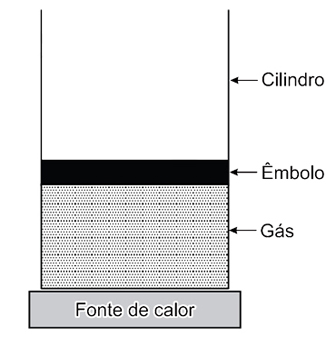
Considere duas situações:
I. o êmbolo pode mover-se livremente, permitindo que o gás se expanda à pressão constante;
II. o êmbolo é fixo, mantendo o gás a volume constante.
Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar
- A) igualmente em ambas as situações.
- B) mais em I do que em II.
- C) mais em II do que em I.
- D) em I, mas se mantém constante em II.
- E) em II, mas se mantém constante em I.
Resposta:
A alternativa correta é letra C
Pela primeira Lei da Termodinâmica: ΔU = Q - W
Caso I: Sendo o aquecimento isobárico e com W = PΔV, temos ΔU1 = Q - PΔV.
Caso II: Sendo o aquecimento isovolumétrico, ΔV = 0 ⇒ W = 0, assim ΔU2 = Q
É fácil perceber que ΔU1 < ΔU2.
Como a energia interna depende apenas da temperatura, temos que ΔT1 < ΔT2.

Deixe um comentário