Questões Sobre Termodinâmica - Física - Vestibular Tradicional
21) Considerando a afirmação presente no texto I “a tendência das coisas de se desordenarem espontaneamente é uma característica fundamental da natureza”, e com base nos conhecimentos sobre as leis da termodinâmica, assinale a alternativa correta.
- A) Quando dois corpos com temperaturas diferentes são colocados em contato, ocorre a transferência espontânea de calor do corpo mais quente para o mais frio.
- B) O calor, gerado por um motor a explosão, pode ser convertido de maneira espontânea e integralmente em energia mecânica, elétrica, química ou nuclear.
- C) O nitrogênio e o hélio misturados e contidos em um recipiente se separam de modo espontâneo após o equilíbrio térmico do sistema.
- D) Uma máquina térmica perfeita opera, na prática, em ciclos, converte o calor integralmente em trabalho e é capaz de funcionar como um moto-perpétuo.
- E) As moléculas de tinta que tingem uma porção de água de maneira homogênea tendem a se agrupar espontaneamente e com isso restaurar a gota de tinta original.
A alternativa correta é letra A
Vamos analisar cada alternativa.
A alternativa B) está incorreta, o calor não é convertido espontaneamente em outras formas de energia, por exemplo, vamos supor que essa explosão vá movimentar um pistão, com a explosão há uma expansão dos gases e estes movimentam o pistão.
A alternativa C) está incorreta, a probabilidade de que amostras de gases, sejam eles hélio e hidrogênio por exemplo, se separem espontaneamente depois de misturados é praticamente nula.
Na alternativa D), quando se fala "na prática" subtende-se que essa máquina exista, o que é impossível, não podemos criar máquinas perfeitas, seriam máquinas que converteriam 100% o calor em trabalho, sem nenhuma perda.
Na alternativa E) temos um outro exemplo de situação praticamente impossível, uma vez que a gota de tinta se esparrama pela água, o universo provavelmente vai acabar antes de vermos tal acontecimento.
Por fim, a alternativa que sobra é a A) e ela é a correta, isto porque a transferência de calor entre corpos com temperaturas diferentes ocorre espontaneamente, desde que seja do mais quente para o mais frio. Isto porque esse fenômeno tem uma variação de entropia positiva, e isso implica em um fenômeno espontâneo.
A alternativa B) está incorreta, o calor não é convertido espontaneamente em outras formas de energia, por exemplo, vamos supor que essa explosão vá movimentar um pistão, com a explosão há uma expansão dos gases e estes movimentam o pistão.
A alternativa C) está incorreta, a probabilidade de que amostras de gases, sejam eles hélio e hidrogênio por exemplo, se separem espontaneamente depois de misturados é praticamente nula.
Na alternativa D), quando se fala "na prática" subtende-se que essa máquina exista, o que é impossível, não podemos criar máquinas perfeitas, seriam máquinas que converteriam 100% o calor em trabalho, sem nenhuma perda.
Na alternativa E) temos um outro exemplo de situação praticamente impossível, uma vez que a gota de tinta se esparrama pela água, o universo provavelmente vai acabar antes de vermos tal acontecimento.
Por fim, a alternativa que sobra é a A) e ela é a correta, isto porque a transferência de calor entre corpos com temperaturas diferentes ocorre espontaneamente, desde que seja do mais quente para o mais frio. Isto porque esse fenômeno tem uma variação de entropia positiva, e isso implica em um fenômeno espontâneo.
Questão 22
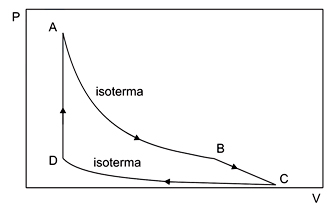
Com base nesse gráfico, analise as afirmações.
I. Durante a transformação A→B, a energia interna se mantém inalterada.
II. A temperatura na transformação C→D é menor do que a temperatura na transformação A→B.
III. Na transformação D→A, a variação de energia interna é igual ao calor absorvido pelo gás.
I. Durante a transformação A→B, a energia interna se mantém inalterada.
II. A temperatura na transformação C→D é menor do que a temperatura na transformação A→B.
III. Na transformação D→A, a variação de energia interna é igual ao calor absorvido pelo gás.
Dessas três afirmações, estão corretas:
- A) I e II, apenas.
- B) III, apenas.
- C) I e III, apenas.
FAZER COMENTÁRIO- D) II e III, apenas.
- E) I, II e III.
A alternativa correta é letra E
I - Correta. A transformação A→B é uma transformação isotérmica. Uma vez que a energia interna é uma função da temperatura, como não há variação, a energia interna também se mantém constante.II - Correta. Quanto mais afastadas do eixo P X V, maior a temperatura representada por uma isoterma, pois P.V/T = P'V'/T'.III - Correta. Como é uma transformação isovolumétrica, não há transferência de energia em forma de trabalho, havendo apenas troca de calor e, assim, variando diretamente a energia interna.Alternativa correta letra E.23) Uma dada massa de um gás perfeito sofre uma transformação isotérmica, cedendo para o meio externo uma quantidade de calor de 500J. Qual a variação de energia interna sofrida pelo gás?
FAZER COMENTÁRIO- A) 1000J
- B) 500J
- C) 250J
- D) 100J
- E) 0J
A alternativa correta é letra E
Pela Primeira Lei da Termodinâmica :ΔU=Q-WSendo:ΔU= Variação da energia internaQ= calor trocado com meio externoW= trabalho realizado no processoO processo em questão é isotérmico (temperatura constante), portanto, a variação da energia interna é nula (ΔU=0). Logo, resposta correta é a letra E.24) O número de mols do gás é de aproximadamente:
FAZER COMENTÁRIO- A) 222 mols
- B) 232 mols
- C) 242 mols
- D) 252 mols
- E) 262 mols
A alternativa correta é letra A
O número de mols pode ser calculado utilizando a equação Clayperon no estado A, portanto :Pa.Va=nRTa=12.105=8,31.650.nn= 222 molsAlternativa A.25) Numa mina subterrânea a 480m de profundidade, os trabalhadores colocaram determinada porção de água para ferver em um recipiente aberto. Nessas condições, espera-se que a água entre em ebulição quando atingir:
- A) a temperatura de 300K
- B) a temperatura de 100º C
- C) uma temperatura inferior a 100º C
- D) uma temperatura superior a 212º F
FAZER COMENTÁRIO- E) a temperatura de 273K
A alternativa correta é letra D
Sabe-se que quanto maior for a profundidade, maior será a pressão atmosférica. Em consequência disso, a água terá um aumento no seu ponto de ebulição. O ponto de ebulição da água nas diferentes escalas, é :Escala Celsius : 100 ºCEscala Kelvin : 373 KEscala Fahrenheit : 212 ºFPor exclusão de alternativas, conclue-se que a água deverá ter uma temperatura maior do que 212 ºF para ebulir.Resposta letra D.26) Transformação gasosa adiabática é uma transformação em que o gás passa de um estado a outro sem receber ou ceder calor para o ambiente. Essa transformação pode ser obtida, na prática, se isolarmos termicamente o sistema ou se a transformação for realizada rapidamente. Baseado nessas informações. Assinale a alternativa correta.
- A) Numa transformação adiabática, a variação de energia interna do sistema é inversamente proporcional ao trabalho.
- B) Numa compressão adiabática, a temperatura do gás aumenta.
- C) Numa transformação adiabática o gás não se resfria nem esquenta.
- D) Em uma transformação adiabática, não há realização de trabalho.
FAZER COMENTÁRIO- E) Em qualquer transformação adiabática, a pressão exercida pelo gás se mantém constante.
A alternativa correta é letra C
Em um processo adiabático não há trocas de calor entre o sistema e o meio externo. A Quantidade de Calor Q é descrita por :Q=m.c.ΔTSendo :m - massac - calor específicoΔT - variação de temperaturaNuma transformação adiabática Q=0, logo, ΔT=0 . Portanto, conclue-se que o gás não sofre variação de temperatura, ou seja, não é resfriado e nem esquenta.Alternativa C.27) A variação da energia interna do gás é de aproximadamente:
FAZER COMENTÁRIO- A) 1,0. 106 J
- B) 1,5. 106 J
- C) 2,0. 106 J
- D) 2,5. 106 J
- E) 3,0. 106 J
A alternativa correta é letra B
No estado A, pela equação geral dos gases, temos :Pa.Va=nRTa12.105=8,31.650.nn= 222 molsFazendo o mesmo processo para o estado B, substituindo o n encontrado, obtemos : T = 108 KSabendo que a Energia Interna U é:U=3nRT/2Basta calcularmos a Energia Interna nos pontos A e B, para determinarmos sua variação :Ua=nRTa=222.8,31.650.3/2= 1798699 JUb=nRTb= 222.8,31.108.3/2 = 298860 JPortanto, Ub-Ua = -14998839 J = -1,5.106 J . Em módulo : 1,5.106 J .Alternativa B.28) Certa massa de gás perfeito tem volume V0, pressão P0 e temperatura igual a 327ºC. Quando o volume for V0/2 e a pressão 4P0/3, a temperatura, em ºC será igual a:
- A) 127.
- B) 200.
- C) 227.
- D) 427.
FAZER COMENTÁRIO- E) 900.
A alternativa correta é letra A
Como se trata de um gás perfeito, podemos utilizar a equação:(P0.V0)/600 = [(4P0/3).(V0/2)]/T2T2 = 400 KComo a resposta foi pedida em °C, basta subtraírmos: 400 - 273 = 127 °C29) Em um freezer, muitas vezes, é difícil repetir a abertura da porta pouco tempo após ter sido fechado, devido a diminuição da pressão interna. Essa diminuição ocorre porque o ar que entra, à temperatura ambiente, é rapidamente resfriado até a temperatura de operação, em torno de -18º C. Considerando um freezer domestico, de 280 litros, bem vedado, em um ambiente a 27º C e pressão atmosférica Po, a pressão interna poderia atingir o valor mínimo de (considere que todo o ar no interior do freezer, no instante em que a porta é fechada, esta a temperatura do ambiente):
- A) 35% de Po
- B) 50% de Po
- C) 67% de Po
- D) 85% de Po
FAZER COMENTÁRIO- E) 95% de Po
A alternativa correta é letra D
Considerando que o processo é isovolumétrico, ou seja , o volume é uma constante, podemos utilizar a equação de Clayperon na seguinte forma :* 27 ºC = 300 K-18 º C = 255 KAlternativa D.Continua após a publicidade..30) Por meio de uma bomba de ar comprimido, um tratorista completa a pressão de um dos pneus do seu trator florestal, elevando-a de 1,1 . 105 Pa (16 lbf/pol2) para 1,3.105 Pa (19 lbf/pol2), valor recomendado pelo fabricante. Se durante esse processo a variação do volume do pneu é desprezível, o aumento da pressão no pneu se explica apenas por causa do aumento
FAZER COMENTÁRIO- A) da temperatura do ar, que se eleva em 18% ao entrar no pneu, pois o acréscimo do número de mols de ar pode ser considerado desprezível.
- B) da temperatura do ar, que se eleva em 36% ao entrar no pneu, pois o acréscimo do número de mols de ar pode ser considerado desprezível.
- C) do número de mols de ar introduzidos no pneu, que aumenta em 18%, pois o acréscimo de temperatura do ar pode ser considerado desprezível.
- D) do número de mols de ar introduzidos no pneu, que aumenta em 28%, pois o acréscimo de temperatura do ar pode ser considerado desprezível.
- E) do número de mols de ar introduzidos no pneu, que aumenta em 36%, pois o acréscimo de temperatura do ar pode ser considerado desprezível.
A alternativa correta é letra C
O enunciado fornece que, para que haja aumento de pressão no pneu, bombeia-se ar comprimido, aumentando a quantidade de ar contida no pneu sem que haja qualquer variação de volume ou temperatura. Desta forma, a variação que fornece o aumento de pressão é a variação do número de mols de ar presente no pneu.Pela Lei dos Gases Ideais (equação de Clapeyron), tem-se que:Em uma variação de p = p1 a p = p2 e n = n1 a n = n2, a V e T constantes:Sendo assim:O aumento percentual de n1 para n2 foi de 18%, como afirma a alternativa C. - B) 50% de Po
- B) 200.
- B) Numa compressão adiabática, a temperatura do gás aumenta.
- B) a temperatura de 100º C
