Questões Sobre Termodinâmica - Física - Vestibular Tradicional
31) Um gás ideal encontra-se inicialmente a uma temperatura de 150º C e a uma pressão de 1,5 atm. Mantendo-se a pressão constante, seu volume será dobrado se sua temperatura aumentar para, aproximadamente:
- A) 75º C.
- B) 45º C.
- C) 300º C.
- D) 846º C.
- E) 573º C.
A alternativa correta é letra E
Utilizando a Equação Geral dos Gases :
* K=C+273
Alternativa E.
32) De acordo com a lei de Robert Boyle (1660), para proporcionar um aumento na pressão de uma determinada amostra gasosa numa transformação isotérmica, é necessário :
- A) aumentar o seu volume
- B) diminuir a sua massa
- C) aumentar a sua temperatura
- D) diminuir seu volume
- E) aumentar a sua massa
A alternativa correta é letra D
Pela Lei de Boyle , dada temperatura constante, ao aumentarmos o volume a pressão diminuirá (vice-versa). Conclue-se que o volume e a pressão são grandezas inversamente proporcionais, conforme equação:
P1.V1=P2.V2
Portanto, caso quisermos diminuir V2 (volume), basta aumentarmos P2 (pressão) de modo que a igualdade seja verdadeira. Logo, a alternativa correta é a letra D.
33) De acordo com a lei de Robert Boyle em 1666, para proporcionar um aumento na pressão de uma determinada amostra gasosa numa transformação isotérmica, é necessário:
- A) aumentar o seu volume
- B) diminuir a sua massa
- C) aumentar a sua temperatura
- D) diminuir o seu volume
FAZER COMENTÁRIO- E) aumentar a sua massa
A alternativa correta é letra D
A pressão e o volume são grandezas inversamente proporcionais, ou seja, para aumentarmos a pressão, é necessário que haja diminuição no volume. Essa relação é evidente quando descrita pela Lei de Boyle para uma transformação isotérmica :P1.V1=P2.V2Alternativa D34) A temperatura final da transformação vale, aproximada-mente:
FAZER COMENTÁRIO- A) 108 K
- B) 208 K
- C) 308 K
- D) 408 K
- E) 508 K
A alternativa correta é letra A
Utilizando a Equação de Clayperon no estado A para obtermos a quantidade de mols :Pa.Va=nRTa= 12.105=8,31.650.nn= 222 molsUtilizando a Equação de Clayperon no estado B e substituindo o n encontrado :Pb.Vb=nRTb = 2.105 = 222.8,31.TbTb= 108 KAlternativa A.Questão 35
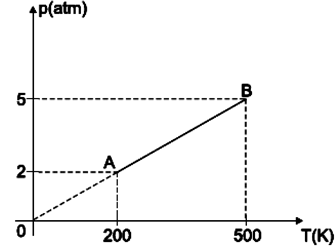 Qual o tipo de transformação sofrida pelo gás?
Qual o tipo de transformação sofrida pelo gás?- A) Isovolumétrica
- B) Isobárica
- C) Isotérmica
- D) Adiabática
FAZER COMENTÁRIO- E) Isométrica e Isobárica
A alternativa correta é letra A
Por exclusão de alternativas e sabendo que num estado termodinâmico de variáveis (P,V,T)= (pressão, volume, temperatura) apenas uma delas é constante, portanto, pelo gráfico, que a transformação é isovolumétrica, pois a pressão e temperatura variam.Alternativa A.Questão 36
 Analise, então, as afirmativas:I. A energia interna do estado 1 é maior do que a energia interna do estado 2.II. No processo 1→3, o gás não realiza trabalho contra a vizinhança.III. No processo 1→2, o gás recebe energia e também fornece energia para a vizinhança.Está(ão) correta(s):
Analise, então, as afirmativas:I. A energia interna do estado 1 é maior do que a energia interna do estado 2.II. No processo 1→3, o gás não realiza trabalho contra a vizinhança.III. No processo 1→2, o gás recebe energia e também fornece energia para a vizinhança.Está(ão) correta(s):- A) apenas I.
- B) apenas II.
- C) apenas III.
- D) apenas II e III.
FAZER COMENTÁRIO- E) I, II e III.
A alternativa correta é letra D
A assertiva I é falsa. A isoterma da curva com o estado 2 está acima da curva com o estado 1, logo, sua energia interna é maior. A assertiva II é verdadeira. No processo de 1→3 o volume é uma constante (ΔV=0), portanto, o trabalho W definido como o produto da pressão P pela variação de volume ΔV será nulo. E, por fim, a assertiva III também é verdadeira. O processo 1→2 é isobárico, realiza trabalho e tem quantidade de calor Q diferente de zero. Estão coerntes as assertivas II e III, portanto, a resposta correta é a alternativa D.37) Numa transformação à pressão constante, o volume de um gás ideal aumentou de 0,2 m3 para 0,6 m3, sob pressão de 5 N/m2. Durante o processo, o gás recebeu 5 J de calor do ambiente. A variação da energia interna do gás foi de:
FAZER COMENTÁRIO- A) 0 J
- B) 3 J
- C) 5 J
- D) 20 J
- E) 30 J
A alternativa correta é letra B
Pela Primeira Lei da Termodinâmica :ΔU=Q-W (1)Sendo:ΔU= Variação da energia internaQ= calor trocado com meio externoW= trabalho realizado no processoO processo em questão é isobárico, portanto, a pressão P é uma constante. Sabe-se que o trabalho a pressão constante, pode ser calculado como :W=P.ΔV (ΔV é a variação de volume)Substituindo os dados da questão na expressão acima, obtemos :W=5.0,4= 2JPelo enunciado, Q= 5J, logo, em (1) vem :ΔU= 5 - 2 = 3JAlternativa correta é a letra B.38) A pressão total sobre uma bolha de ar, no fundo de um lago, é de 3 atm. Essa bolha sobe para a superfície do lago, cuja temperatura é de 27°C, e tem seu volume quadruplicado. Considerando a pressão atmosférica no local de 0,8 atm, a temperatura no fundo do lago será de, aproximadamente, em ºC,
- A) 2.
- B) 4.
- C) 8.
- D) 12.
FAZER COMENTÁRIO- E) 20.
A alternativa correta é letra C
Substituindo os dados da questão na Equação Geral dos Gases Perfeitos, temos,
Fundo do lago:Superfície do lago:Pela Equação dos Gases Perfeitos:Isolando T0 obtemos 281,25K, ou aproximadamente 8 °C. Portanto, a resposta correta é a alternativa C.39) Um recipiente rígido contém 0,5 ml de gás perfeito à temperatura de 27º C e pressão de 1,2 atm. Esse recipiente é provido de uma válvula que libera gás sempre que a pressão excede 1,6 atm. Calcule a temperatura do gás em Kelvin, quando for igual a 1,5 atm.
- A) 3,8 10²K.
- B) 4,8 10²K.
- C) 10,5 10²K.
- D) 20,2 10²K.
FAZER COMENTÁRIO- E) 5,4 10²K.
A alternativa correta é letra A
Para resolver essa questão, vamos utilizar a lei geral dos gases perfeitos:Como o volume permanece constante, anularemos V1 e V2. Para trabalharmos com esta lei, a temperatura percisa estar em Kelvin, para transformar de °C para Kelvin, basta somar com 273.T2 = 375 K ou aproximadamente 3,8.102 K.Alternativa A.Continua após a publicidade..40) Dentre as transformações realizadas por um gás ideal, é certo que:
- A) não há variação da energia interna nas transformações isobáricas.
- B) a temperatura se mantém constante, tanto nas transformações isotérmicas quanto nas isométricas.
- C) nas transformações adiabáticas não há troca de calor entre o gás e o recipiente que o contém.
- D) não há realização de trabalho nas transformações isotérmicas, uma vez que nelas o volume não varia.
FAZER COMENTÁRIO- E) tanto a pressão quanto o volume do gás se mantêm constantes nas transformações isométricas.
« Anterior 1 2 3 4 5 6 … 8 Próximo »A alternativa correta é letra C
Vamos analisar cada uma das alternativas. A alternativa A é falsa; na transformação isobárica não há variação de pressão. A alternativa B também é falsa; a temperatura não é mantida constante nas transformações isométricas (em que o volume é constante). A alternativa C é verdadeira; por definição, uma transformação adiabática possui Q=0, ou seja, as trocas de calor entre o gás e sua vizinhança são nulas. A alternativa D, por sua vez, é falsa; nas transformações isotérmicas, ΔU=0 e pela Primeira Lei da Termodinâmica, o trabalho W nessa condição é W=Q. E, por fim, a alternativa E também é falsa; na transformação isométrica, apenas o volume é constante. Portanto, a resposta correta é a alternativa C. - B) a temperatura se mantém constante, tanto nas transformações isotérmicas quanto nas isométricas.
- B) 4,8 10²K.
- B) 4.
- B) apenas II.
- B) Isobárica
- B) diminuir a sua massa
