Questões Sobre Termodinâmica - Física - Vestibular Tradicional
41) Cinco mol de gás perfeito ocupam um volume de 5 m³ sob pressão de 2,0 atm e temperatura de 47 ºC. Sofrendo uma transformação isocórica até que a pressão passa a ser de 3,0 atm. A nova temperatura em Celsius do gás após a transformação é de:
- A) 24,6.
- B) 70,5.
- C) 207.
- D) 320.
FAZER COMENTÁRIO- E) 400.
A alternativa correta é letra C
Utilizando a Lei Geral dos Gases e substituindo os dados fornecidos no enunciado :* K=C+273Alternativa C.42) Considere as afirmações abaixo, sobre gases ideais.
- A) Apenas I.
- B) Apenas II.
- C) Apenas III.
- D) Apenas I e II.
FAZER COMENTÁRIO- E) I, II e III.
A alternativa correta é letra E
Todas as proposições estão corretas (ALTERNATIVA E). De fato:
I. O fato da constante R ser válida, é justamente o que define um gás ideal. Para gases reais, este comportamento é aproximadamente respeitado em condições de temperatura e pressão suficientemente afastadas dos pontos de mudança de fase.
II. Nas CNTP, temos sempre que cada 1 mol de gás ideal equivalerá a 22,4 L, e vice-versa. Essa correlação também é válida em outras temperaturas para outros volumes.
III. É empiricamente comprovado que a energia interna de um gás ideal é dada por U = kT, onde k é uma constante e T é a temperatura deste gás.43) Assinale a alternativa que preenche corretamente as lacunas do texto abaixo.
- A) adiabática – interna
- B) isotérmica – cinética
- C) isotérmica – interna
- D) adiabática – potencial.
FAZER COMENTÁRIO- E) isobárica - interna
A alternativa correta é letra A
Um processo que ocorre com alta velocidade pode ser considerado como adiábatico, tendo sua quantidade de calor Q=0 (não há trocas de energia com o sistema e o meio externo). Nesse caso, pela primeira lei da Termodinâmica, o trabalho W é igual ao módulo da variação da energia interna ΔU :ΔU = Q - W , mas Q=0ΔU = -WLogo, a alternativa que preenche corretamente as lacunas é a letra A.44) Uma certa quantidade de gás ideal ocupa um volume V0 quando sua temperatura é T0 e sua pressão é P0. Expande-se, então, o gás, isotermicamente, até duplicar o seu volume. A seguir, mantendo o seu volume constante, sua pressão é restabelecida ao valor original P0. Qual a temperatura final do gás neste último estado de equilíbrio térmico?
- A) T0/4.
- B) T0.
- C) 4xT0.
- D) T0/2.
FAZER COMENTÁRIO- E) 2xT0.
A alternativa correta é letra E
O gás com variáveis termodinâmicas Po,Vo,To sofre uma transformação isotérmica até duplicar seu volume, logo, pela Lei de Boyle, obtemos :
Depois o gás sofre uma transformação isovolumétrica e sua pressão volta a ser Po, portanto, pela Lei Geral dos Gases :Alternativa E.45) Uma sala tem 6m de largura, 10 m de comprimento e 4 m de altura. Deseja-se refrigerar o ar dentro da sala. Considere o calor específico do ar como sendo 30 J/mol K (use R = 8 J/mol K). Considerando o ar dentro da sala como um gás ideal à pressão ambiente P = 1 x 105 N/m², quantos mols de gás existem dentro da sala a 27 ºC?
- A) 2 x 10²
- B) 1x 10²
- C) 3 x 10 ³
- D) 2 x 104
FAZER COMENTÁRIO- E) 1x 104
A alternativa correta é letra E
Utilizando a Equação de Clapeyron :P.V=n.R.TP=1.105 N/m²V = 6.10.4= 240 m³T = 27 ºC = 300 KR = 8 J/mol KLogo,n = P.V/ R.T = 1.105 . 240 / 300.8 = 10000 = 1.104 molsAlternativa E.Questão 46
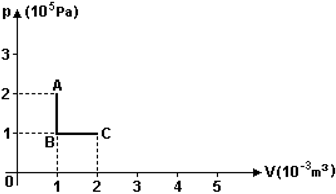 Sendo a temperatura no estado A igual a 327°C, a temperatura no estado C, em °C é:
Sendo a temperatura no estado A igual a 327°C, a temperatura no estado C, em °C é:- A) 82.
- B) 164.
- C) 327.
- D) 491.
FAZER COMENTÁRIO- E) 654.
A alternativa correta é letra C
De A para B há uma transformação isocórica (volume constante), logo :De B para C, configura-se um processo isobárico (pressão constante) :* K = C + 273Alternativa C.47) Um químico recolhe um gás a 18ºC, cujo volume é de 500 cm³. Para dimensionar a capacidade do recipiente, ele precisa conhecer qual será o volume do gás a 0ºC, se a pressão for mantida constante. O volume do gás será, em cm³, de:
- A) 291.
- B) 429.
- C) 439.
- D) 391.
FAZER COMENTÁRIO- E) 469.
A alternativa correta é letra E
Pela Lei Geral dos Gases para pressão constante :Alternativa E.48) O bico de uma seringa de injeção é completamente vedado, de modo a encerrar 1,0 cm³ de ar no interior da mesma, nas condições ambientais de temperatura e pressão. A seguir, puxa-se lentamente o êmbolo (como mostra a figur
- A). O gráfico ao lado representa a variação da pressão P do ar em função do seu volume V. Sabendo-se que a transformação é isotérmica e desprezando os atritos. Calcule a pressão do gás no estado B.
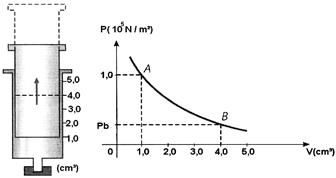 FAZER COMENTÁRIO
FAZER COMENTÁRIOA alternativa correta é letra B
Utilizando a Lei de Boyle para transformações isotérmicas, temos :P1.V1 = P2.V2Logo,Pa.Va = Pb.Vb1.105.1.10-6 = 4.10-6. PbPb = 2,5.104 N/m²Alternativa B.49) A temperatura de certa quantidade de gás ideal, à pressão de 1,0 atm, cai de 400K para 320K. Se o volume permaneceu constante, a nova pressão é de:
- A) 0,8atm.
- B) 0,9atm.
- C) 1,0atm.
- D) 1,2atm.
FAZER COMENTÁRIO- E) 1,5atm.
A alternativa correta é letra A
Pela Lei Geral dos Gases para volume constante :P 1 T 1 = P 2 T 2 1 400 = P 2 320 P 2 = 0 , 8 a t m Alternativa A.Continua após a publicidade..Questão 50
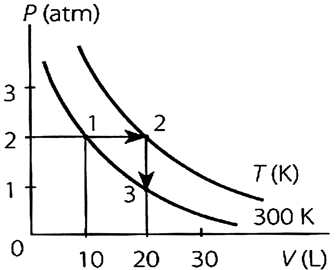
- A) a temperatura do gás no estado 2 é 450K
- B) a pressão do gás no estado 3 é 2 atm
- C) a temperatura do gás no estado 3 é 600K
- D) o volume do gás no estado 2 é 10L.
FAZER COMENTÁRIO- E) a pressão do gás no estado 2 é 2atm.
« Anterior 1 … 3 4 5 6 7 8 Próximo »A alternativa correta é letra E
Pelo gráfico, nota-se que no estado 2, a pressão do gás é de 2 atm. Alternativa E. - B) a pressão do gás no estado 3 é 2 atm
- B) 0,9atm.
- A) 0,8atm.
- B) 429.
- B) 164.
- B) 1x 10²
- B) T0.
- B) isotérmica – cinética
- B) Apenas II.
- B) 70,5.
