Questões Sobre Termodinâmica - Física - Vestibular Tradicional
Questão 51
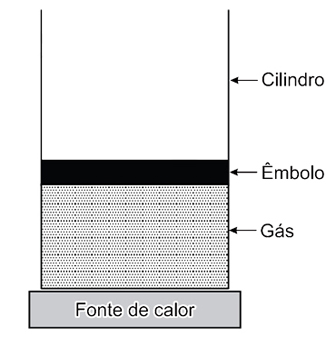
Considere duas situações:
I. o êmbolo pode mover-se livremente, permitindo que o gás se expanda à pressão constante;
II. o êmbolo é fixo, mantendo o gás a volume constante.
Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar
- A) igualmente em ambas as situações.
- B) mais em I do que em II.
- C) mais em II do que em I.
- D) em I, mas se mantém constante em II.
FAZER COMENTÁRIO- E) em II, mas se mantém constante em I.
A alternativa correta é letra C
Pela primeira Lei da Termodinâmica: ΔU = Q - WCaso I: Sendo o aquecimento isobárico e com W = PΔV, temos ΔU1 = Q - PΔV.Caso II: Sendo o aquecimento isovolumétrico, ΔV = 0 ⇒ W = 0, assim ΔU2 = QÉ fácil perceber que ΔU1 < ΔU2.Como a energia interna depende apenas da temperatura, temos que ΔT1 < ΔT2.52) A variação da energia interna do sistema ao ser levado de A para C é de:
- A) 120J.
- B) 130J.
- C) 140J.
- D) 150J.
- E) 160J.
FAZER COMENTÁRIOA alternativa correta é letra D
A variação de energia interna de um gás, será dada pela sua fórmula:O trabalho foi calculado na questão anterior, sendo este dado pela área do trapézio formado pelos pontos A e C com o eixo x, essa área equivale à 150 u.c. ou, transformando pra trabalho, 150 J. Já Q é a quantidade de calor fornecida ou recebida, que já foi dada na questão e corresponde a 300 J.300 = 150 - ΔUΔU = 150 JAlternativa D.53) Sem variar sua massa, um gás ideal sofre uma transformação a volume constante. É correto afirmar que:
FAZER COMENTÁRIO- A) a transformação é isotérmica.
- B) a transformação é isobárica.
- C) o gás não realiza trabalho.
- D) sua pressão diminuirá se a temperatura do gás aumentará.
- E) a variação de temperatura do gás será a mesma em qualquer escala termométrica.
A alternativa correta é letra C
Em um processo isocórico (ΔV=0), o gás não sofre variação de volume. Sabendo que o trabalho W de um gás é dado por :W=P.ΔVSendo :P - PressãoΔV - Variação de volumeConlue-se que W=0 . Resposta correta é a alternativa C.54) Quanto à 1.ª Lei da Termodinâmica, podemos afirmar que:
FAZER COMENTÁRIO- A) a troca de calor com o meio exterior é igual ao trabalho realizado no processo menos a variação da energia interna.
- B) o trabalho realizado no processo é igual ao calor trocado com o meio exterior mais a variação da energia interna.
- C) a variação da energia interna é igual ao calor trocado com o meio exterior mais o trabalho realizado no processo.
- D) o calor trocado com o meio exterior é igual ao trabalho realizado no processo mais a variação da energia interna.
- E) o trabalho realizado no processo é igual ao calor trocado com o meio exterior.
A alternativa correta é letra D
A Primeira Lei da Termodinâmica diz que a variação da energia interna (ΔU) é igual ao calor trocado com o meio externo (Q) menos o trabalho (W) realizado, portanto :ΔU = Q - WQ = ΔU + WLogo, a resposta correta é a letra D.Questão 55
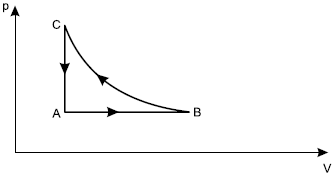 A respeito dessas transformações, afirmou-se o seguinte:
A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em:Note e adote:
O gás deve ser tratado como ideal; a transformaçãoé isotérmica.
FAZER COMENTÁRIO- A) I
- B) II
- C) III
- D) I e II
- E) II e III
A alternativa correta é letra E
Vamos analisar cada uma das afirmativas. A primeira afirmativa nos diz que o trabalho total deste ciclo é nulo, para isso vamos analisar cada uma das três partes deste ciclo, para desco b rir o trabalho em cada momento. De A para B temos um processo isobárico, ou seja, a pressão é constante. Com isso, temos que o trabalho é dado pela fórmula:W = −pVdado que W é o trabalho, p é a pressão eV = Vf − Viisto é, a variação no volume. Sabemos que W>0 quer dizer que o sistema recebeu trabalho, e W<0 que o sistema realizou trabalho. No processo em questão como o volume final é maior q ue o inicial, então:W = −p1(V2 − V1).No processo B para C temos um processo isotérmico, como informado. Assim sendo,W = nRTln(V2/V1)Dado que n é o número de mols do gás, R é a constante universal dos gases perfeitos e T é a temperatura. E por fim temos o processo de C para A, onde por ser isocórico o trabalho é nulo, visto que não tem variação no volume. E assim temos:Wtot = WA→B + WB→C + WC→A
Wtot = −p1(V2 − V1) + nRTln(V2/V1) + 0Além do mais, devemos lembrar que o trabalho total do ciclo é a área da figura, e assim fica evidente que seu valor é diferente de zero, pois a área é diferente de zero. Dessa forma, chegamos que a afirmativa I é falsa. A afirmativa II diz respeito à energia interna deste gás em dois momentos distintos. Como não sabemos se o gás é monoatômico ou poliatômico vamos usar a seguinte expressão:Eint = kpVdado que k é uma variável que depende do grau de liberdade L das partículas (k = L/2), p é a pressão e V é o volume. Com isso, temos:Eint C = kp2V1E,Eint A = kp1V1Como p2>p1 então Eint C>Eint A e a afirmação II é verdadeira. Por fim, a última afirmação diz respeito à transformação A para B. Como já calculamos o trabalho nesta parte, podemos observar que seu valor é negativo, o que implica que o sistema está realizando trabalho. E assim, usamos a primeira lei da termodinâmica:dU = Q + Wem que Q é positivo se o sistema recebe calor, e W é positivo se é realizado trabalho no sistema. Usando a expressão de U mostrada acima, temos:Uf − Ui = kp1V2 − kp1V1 = Q + W
Q = kp1V2 − kp1V1 − WCom isso, já que:V2 > V1Então:kp1V2 > kp1V1E já que:−W > 0Então:Q > 0E assim temos que o sistema recebe calor. Estão coerentes as assertivas II e III, portanto, a resposta correta é a alternativa E.56) Um recipiente contendo um certo gás tem seu volume aumentado graças ao trabalho de 1.664 J realizado pelo gás. Neste processo, não houve troca de calor entre o gás, as paredes e o meio exterior. Considerando que o gás seja ideal, a energia de 1 mol desse gás e a sua temperatura obedecem à relação U=20,8T, onde T é a temperatura medida em Kelvin e a energia U em joules. Pode-se afirmar que, nessa transformação, a variação de temperatura de um mol desse gás, em Kelvin, foi de:
- A) 50
- B) –60
- C) –80
- D) 100
FAZER COMENTÁRIO- E) 90
A alternativa correta é letra C
A 1ª Lei da Termodinâmica determina que o calor fornecido ao gás ou cedido por ele é igual à soma da variação da energia interna com o trabalho realizado pelo gás ou sobre ele, ou seja,Do enunciado, sabe-se que não há trocas de calor entre o gás, o recipiente e o meio externo, ou seja,Q = 0Sabe-se também que o trabalho é realizado pelo gás, portanto,τ > 0Desta forma:A partir do enunciado tem-se a relação entre a energia interna e a temperatura do gás, que é dada por:A variação da energia interna, da mesma maneira, está relacionada com a variação da temperatura por:Assim:Portanto, a resposta correta é a alternativa C.57) A primeira lei da termodinâmica, denominada lei da conservação da energia estabelece :
- A) -125J
- B) -75J
- C) -50J
- D) 75J
FAZER COMENTÁRIO- E) 200J
A alternativa correta é letra C
A Primeira Lei da Termodinâmica diz que a variação da energia interna ΔU é igual à quantididade de calor Q menos o trabalho W :ΔU= Q - WPelo enunciado, vem :ΔU=75-125= -50JAlternativa C.58) Em uma sala fechada e isolada termicamente, uma geladeira, em funcionamento, tem, num dado instante, sua porta completamente aberta. Antes da abertura dessa porta, a temperatura da sala é maior que a do interior da geladeira. Após a abertura da porta, a temperatura da sala,
- A) diminui até que o equilíbrio térmico seja estabelecido.
- B) diminui continuamente enquanto a porta permanecer aberta.
- C) diminui inicialmente, mas, posteriormente, será maior do que quando a porta foi aberta.
- D) aumenta inicialmente, mas, posteriormente, será menor do que quando a porta foi aberta.
FAZER COMENTÁRIO- E) não se altera, pois se trata de um sistema fechado e termicamente isolado.
A alternativa correta é letra C
O problema diz que a porta de uma geladeira é aberta em uma sala fechada e isolada termicamente, ou seja, num sistema que não troca energia e/ou matéria com o meio externo. A porta da geladeira irá resfriar a sala até que o equilíbrio térmico seja atingido. Após isso, a temperatura do sistema tenderá a aumentar, pois o motor da geladeira libera calor continuamente. Com os dados do enunciado não é possível dizer se este aumento de temperatura será maior do que a temperatura inicial da sala, para isso, seria necessário saber o balanço energético entre a produção de energia térmica pelo motor da geladeira e a liberação da mesma. Entretanto, em relação ao que foi dito acima, fica claro o erro das alternativas A,B,D e E. Além disso, podemos usar o conceito de máquina térmica real (mesmo sem a indicação no enunciado) e afirmar que o calor cedido pelo motor será maior do que o trabalho realizado, tendo parte desse calor liberado.
Portanto, a alternativa correta é a letra C.59) James Prescott Joule contribuiu significativamente para com a termodinâmica, desenvolvendo um trabalho experimental para determinar o valor do equivalente mecânico do calor. Como esta variável dependia da precisão dos valores dos calores específicos de várias substâncias, Joule analisou os diferentes métodos utilizados por cientistas e concluiu que havia a necessidade de um novo método, mais preciso, que hoje é conhecido como efeito Joule.
- A) máquina de secar roupa à gás.
- B) lâmpada fluorescente.
- C) rádio transmissor.
- D) liquidificador.
FAZER COMENTÁRIO- E) fusível.
A alternativa correta é letra E
Dentre as alternativas, o fusível é o único que utiliza o efeito Joule como príncipio de fundamento. À medida que a corrente elétrica cresce, a temperatura do fuspivel se eleva. Caso a corrente seja muito grande (em um curto circuito, por exemplo) o fusível ao transformar energia elétrica em térmica, se funde, evitando assim que os aparelhos do circuito sejam danificados. A resposta correta é a letra E.Continua após a publicidade..Questão 60
- A) 100J
- B) 150J
- C) 250J
- D) 350J
FAZER COMENTÁRIO- E) 400J
« Anterior 1 … 4 5 6 7 8 Próximo »A alternativa correta é letra B
A variação da energia interna ΔU pode ser calculada pela Primeira Lei da Termodinâmica, que diz :ΔU = Q-WNuma transformação isobárica, o trabalho é :W=P.ΔVPelo gráfico, temos :W = 20.5 = 100 JComo são absorvidos 250 J de calor, conclue-se que Q=250 J, logo :ΔU = Q-W = 250 -100 = 150 JAlternativa correta : B. - B) 150J
- B) lâmpada fluorescente.
- B) diminui continuamente enquanto a porta permanecer aberta.
- B) -75J
- B) –60
- B) 130J.
- B) mais em I do que em II.
