Questões Sobre Substâncias e Misturas - Química - 1º ano do ensino médio
1) Um cientista, a fim de verificar a pureza de uma substância sólida a qual acabou de sintetizar, submeteu uma fração da substância ao aquecimento e observou a variação de temperatura durante a fusão da substância. Esse princípio baseia-se no fato de que:
- A) uma substância pura tem ponto de fusão constante e de ebulição variável.
- B) uma substância pura tem ponto de fusão e de ebulição variáveis.
- C) uma substância pura tem ponto de fusão e de ebulição constantes.
- D) uma substância pura tem ponto de fusão que pode variar em até 1ºC devido às alterações nas condições de pressão do ambiente.
- E) uma substância pura tem ponto de fusão variável e de ebulição constante.
A resposta correta é C) uma substância pura tem ponto de fusão e de ebulição constantes..
Uma substância pura tem ponto de fusão e de ebulição constantes. Isso ocorre porque a temperatura de fusão é a temperatura na qual a energia cinética das moléculas de uma substância é suficiente para quebrar as forças intermoleculares que as mantêm unidas, e a temperatura de ebulição é a temperatura na qual a pressão de vapor da substância é igual à pressão atmosférica.
Para uma substância pura, essas temperaturas são constantes, pois a composição da substância é uniforme e as forças intermoleculares são as mesmas em todas as partes da substância.
Portanto, se o cientista observar que a temperatura de fusão da substância varia durante o experimento, isso indica que a substância não é pura, pois é composta por mais de uma substância com diferentes pontos de fusão.
2) O bronze (utilizado para fabricação de medalhas olímpicas, dadas aos 3ºs colocados de cada competição), o “gelo seco” (CO2 usado para produção de fumaça artificial) e o diamante (usado em muitas joias preciosas) são, respectivamente, exemplos de:
- A) mistura, substância simples e substância composta.
- B) mistura, substância composta e substância simples.
- C) substância composta, mistura e substância simples.
- D) substância composta, substância simples e mistura.
- E) substância simples, mistura e substância composta.
Alternativa correta B) mistura, substância composta e substância simples.
O bronze é uma mistura de cobre e estanho, portanto é uma mistura de elementos.
O “gelo seco” (dióxido de carbono, CO2) é uma substância composta, pois é formado por átomos de carbono e átomos de oxigênio.
O diamante é uma substância simples, pois é formado apenas por átomos de carbono.
3) (Unesp) O rótulo de uma garrafa de água mineral está reproduzido a seguir:
- A) substância pura.
- B) substância simples.
- C) mistura heterogênea.
- D) mistura homogênea.
- E) suspendo coloidal.
Alternativa correta letra D) mistura homogênea
A água mineral é considerada uma mistura homogênea porque, embora contenha substâncias dissolvidas, como o sulfato de cálcio e o bicarbonato de cálcio, essas substâncias estão uniformemente distribuídas na água. Não é possível distinguir ou observar separadamente os constituintes (sulfato de cálcio e bicarbonato de cálcio) na água mineral. Em uma mistura homogênea, os componentes se misturam de forma que não há regiões com concentrações diferentes. A água mineral é uma substância que apresenta uniformidade em sua composição em toda a garrafa, o que a torna homogênea.
4) (FSulDeMinas) Alguns produtos apresentam-se no comércio como substâncias puras ou misturas. Dentre os produtos relacionados abaixo, temos como substância pura:
- A) o vinho tinto.
- B) o guaraná.
- C) o leite desnatado.
- D) a água destilada.
- E) o óleo trifásico.
Alternativa correta letra D) água destilada
Dentre os produtos mencionados, a água destilada (opção D) é uma substância pura. A água destilada é composta principalmente por moléculas de H2O e é purificada por destilação, o que a torna uma substância pura, sem outros componentes em quantidades significativas.
Questão 5
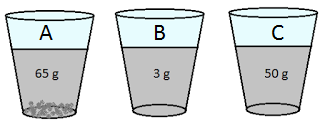
Qual figura representa uma solução diluída, uma solução concentrada e uma solução saturada?
FAZER COMENTÁRIOA solubilidade de uma substância é a quantidade máxima de soluto que pode ser dissolvida em uma determinada quantidade de solvente a uma dada temperatura. Portanto, uma solução saturada é aquela em que a quantidade de soluto que foi dissolvida é igual à solubilidade da substância.
Na figura A, a concentração do soluto é de 65 g/L, que é superior à solubilidade de 60 g/L. Portanto, a solução está saturada.
Na figura B, a concentração do soluto é de 3 g/L, que é menor que a solubilidade de 60 g/L. Portanto, a solução está diluída.
Na figura C, a concentração do soluto é de 50 g/L, que é aproximadamente igual e menor à solubilidade de 60 g/L. Portanto, a solução está concentrada.
6) 1) Sobre o bicarbonato de sódio (NaHCO₃), afirma-se que é:
- A) substância composta e tem quatro átomos em sua molécula.
- B) substância composta, sendo constituída por seis átomos.
- C) substância simples.
- D) substância simples formada por quatro elementos químicos.
- E) uma substância composta formada por três substâncias.
A resposta correta é B) substância composta, sendo constituída por seis átomos.
O bicarbonato de sódio é uma substância composta, pois é formada por dois elementos químicos diferentes: sódio (Na) e hidrogênio (H), além de carbono (C) e oxigênio (O). Cada molécula de bicarbonato de sódio é formada por seis átomos, sendo um átomo de sódio, um átomo de hidrogênio, um átomo de carbono e três átomos de oxigênio.
Portanto, as afirmações (A), (C), (D) e (E) estão incorretas.
Explicação detalhada:
A) O bicarbonato de sódio tem seis átomos em sua molécula, não quatro.
C) O bicarbonato de sódio é uma substância composta, não simples.
D) O bicarbonato de sódio é formado por dois elementos químicos diferentes, não quatro.
E) O bicarbonato de sódio é uma substância composta, não formada por três substâncias.
Questão 7
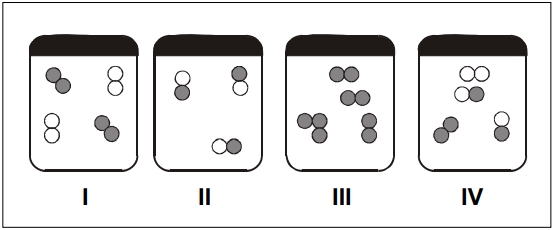
Considerando-se as ilustrações, as misturas são representadas por
- A) I e II.
- B) III e IV.
- C) I, III e IV
- D) II, III e IV.
- E) II e IV.
Alternativa correta letra C) I, III e IV.
As figuras I, III e IV representam misturas, pois apresentam mais de um tipo de átomo ou molécula.
Na figura I, temos dois tipos de moléculas representados pelas cores: preto e branco. Os átomos pretos representam o elemento A e os átomos brancos representam o elemento B. Existem moléculas formadas por 2 átomos pretos e moléculas formadas por 2 átomos brancos.
A figura III representa uma mistura, pois apresenta dois tipos de moléculas: moléculas com 3 átomos e moléculas formadas com 2 átomos.
Na figura IV, temos três tipos de moléculas, portando temos uma mistura.
8) (UFES-ES) Qual é a alternativa em que só aparecem misturas?
- A) Grafite, leite, água oxigenada, fósforo vermelho.
- B) Ferro, enxofre, mercúrio, ácido muriático.
- C) Areia, açúcar, granito, metanol.
- D) Vinagre, álcool absoluto, água do mar, gás amoníaco.
- E) Ar, granito, vinagre, água sanitária.
A resposta correta é E) Ar, granito, vinagre, água sanitária.
As alternativas (A), (B) e (C) apresentam pelo menos uma substância pura.
(A): Grafite, água oxigenada e fósforo vermelho são substâncias puras.
(B): Ferro, enxofre, mercúrio e ácido muriático são substâncias puras.
(C): Areia, açúcar e granito são substâncias puras.
A alternativa (D) apresenta duas misturas: vinagre e água do mar.
Portanto, a única alternativa que apresenta apenas misturas é (E).
Explicação:
- Ar: é uma mistura de gases, composta principalmente de nitrogênio, oxigênio e gás carbônico.
- Granito: é uma mistura de rochas ígneas, sedimentares e metamórficas.
- Vinagre: é uma mistura de ácido acético, água e outros compostos.
- Água sanitária: é uma mistura de hipoclorito de sódio, água e outros compostos.
9) Seja uma mistura formada por: um pouco de areia, uma pitada de sal de cozinha, 100mL de álcool, 100mL de água e cubos de gelo. Quantas fases apresenta o sistema descrito?
A) 1
B) 2
C) 3
D) 4
E) 5
Alternativa correta letra C) 3
Um sistema é uma porção limitada do universo, que é considerada como um todo. Os sistemas podem ser homogêneos ou heterogêneos.
Sistemas homogêneos apresentam as mesmas propriedades em qualquer parte de sua extensão. Por exemplo, a água líquida é um sistema homogêneo, pois apresenta a mesma aparência, cor e densidade em qualquer parte do recipiente.
Sistemas heterogêneos não apresentam as mesmas propriedades em qualquer parte de sua extensão. Por exemplo, uma mistura de areia e água é um sistema heterogêneo, pois a areia e a água podem ser facilmente distinguidas.
As fases são as diferentes porções homogêneas que constituem um sistema heterogêneo. Por exemplo, uma mistura de areia, gelo e água é um sistema heterogêneo com três fases: areia, gelo e água.
Explicação:
A mistura descrita é heterogênea, pois apresenta mais de uma fase. As fases são definidas como regiões do sistema que são fisicamente distintas e que não se misturam.
No sistema descrito, temos as seguintes fases:
- Areia: fase sólida, que pode ser facilmente distinguida da água e do álcool.
- Gelo: fase sólida, que pode ser facilmente distinguida da água e do álcool.
- Solução de sal de cozinha, água e álcool: fase líquida, que é uniforme e não pode ser facilmente distinguida da água.
Portanto, a mistura descrita é heterogênea com três fases.
