Questões Sobre Calorimetria - Física - 2º ano do ensino médio
131) (Makenzie – SP) Em uma manhã de céu azul, um banhista na praia observa que a areia está muito quente e a água do mar está muito fria. À noite, esse mesmo banhista observa que a areia da praia está fria e a água do mar está morna. O fenômeno observado deve-se ao fato de que:
- A) a densidade da água do mar é menor que a da areia.
- B) o calor específico da areia é menor que o calor específico da água.
- C) o coeficiente de dilatação térmica da água é maior que o coeficiente de dilatação térmica da areia.
- D) o calor contido na areia, à noite, propaga-se para a água do mar.
- E) a agitação da água do mar retarda seu resfriamento.
A resposta correta é a letra B), o calor específico da areia é menor que o calor específico da água. Isso significa que a areia precisa de menos calor para aumentar sua temperatura do que a água, e também perde calor mais rápido do que a água. Por isso, a areia fica mais quente durante o dia e mais fria durante a noite, enquanto a água mantém uma temperatura mais constante.
132) (UFES) Dois objetos A e B são constituídos do mesmo material e recebem a mesma quantidade de calor. Observa-se que a variação da temperatura do objeto A é o dobro da variação da temperatura do objeto B. Podemos, então, afirmar que:
- A) a capacidade térmica de B é o dobro da de A.
- B) o calor específico de B é o dobro do de A.
- C) a capacidade térmica de A é o dobro da de B.
- D) o calor específico de A é o dobro do de B.
- E) os dois objetos têm coeficiente de dilatação térmica diferente.
A resposta correta é a letra A) a capacidade térmica de B é o dobro da de A.
A capacidade térmica de B é o dobro da de A. Isso porque a capacidade térmica é definida como a razão entre a quantidade de calor recebida e a variação de temperatura. Se os objetos A e B recebem a mesma quantidade de calor, mas a variação de temperatura de A é o dobro da de B, então a capacidade térmica de B deve ser o dobro da de A, para que a razão seja igual.
Primeiro, vamos lembrar que a capacidade térmica é definida como a razão entre a quantidade de calor recebida e a variação de temperatura. Então, a fórmula da capacidade térmica é:
C = Q / ΔT
Onde:
- C é a capacidade térmica (cal/°C ou J/K)
- Q é a quantidade de calor (cal ou J)
- ΔT é a variação de temperatura (°C ou K)
Agora, vamos supor que os objetos A e B recebem a mesma quantidade de calor Q. Então, podemos escrever as capacidades térmicas de cada um como:
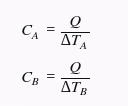
Como o enunciado diz que a variação de temperatura do objeto A é o dobro da variação de temperatura do objeto B, podemos substituir ΔTA por 2ΔTB. Assim, temos:
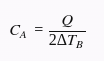
Agora, vamos dividir as duas equações para obter a razão entre as capacidades térmicas dos objetos. Temos:
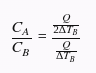
Simplificando, obtemos:
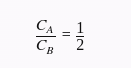
Ou seja, a capacidade térmica de A é metade da capacidade térmica de B. Logo, a capacidade térmica de B é o dobro da capacidade térmica de A. Portanto, a resposta está comprovada.
133) Num dia ensolarado, a água do mar não se aquece tão rapidamente quanto a areia de uma praia. Isso acontece porque:
- A) o calor específico da água é bem maior que o da areia.
- B) a capacidade térmica da água é pequena.
- C) o calor latente da água é pequeno.
- D) o volume de água é muito grande.
- E) o calor específico da areia é maior que o da água.
A alternativa correta é a A) o calor específico da água é bem maior que o da areia.
O calor específico da água é bem maior que o da areia. Isso significa que a água precisa de mais energia para variar a sua temperatura do que a areia. Por isso, num dia ensolarado, a areia se aquece mais rápido e também se esfria mais rápido do que a água.
134) (PUC-MG) Considere dois corpos A e B de mesma massa de substâncias diferentes. Cedendo a mesma quantidade de calor para os dois corpos, a variação de temperatura será maior no corpo:
- A) de menor densidade.
- B) cuja temperatura inicial é maior.
- C) de menor temperatura inicial.
- D) de maior capacidade térmica.
- E) de menor calor específico.
Alternativa correta letra E) de menor calor específico.
O calor específico é a quantidade de calor necessária para elevar a temperatura de 1 g de uma substância em 1 °C. Quanto menor o calor específico, menor a quantidade de calor necessária para a mesma variação de temperatura. Portanto, a resposta correta é a letra E, de menor calor específico.
135) (Fuvest) Um amolador de facas, ao operar um esmeril, é atingido por fagulhas incandescentes, mas não se queima. Isso acontece porque as fagulhas:
- A) têm calor específico muito grande.
- B) têm temperatura muito baixa.
- C) têm capacidade térmica muito pequena.
- D) estão em mudança de estado.
- E) não transportam energia
A resposta correta é a alternativa C, pois as fagulhas têm uma massa muito pequena e, consequentemente, uma capacidade térmica baixa. Isso significa que elas perdem calor rapidamente para o ambiente e não queimam o amolador de facas
136) (UFPR) Para aquecer 500 g de certa substância de 20 °C para 70 °C, foram necessárias 4000 calorias. A capacidade térmica e o calor específico valem, respectivamente:
- A) 8 cal/ °C e 0,08 cal g°C
- B) 80 cal/ °C e 0,16 cal g°C
- C) 90 cal/ °C e 0,09 cal g°C
- D) 95 cal/ °C e 0,15 cal g°C
- E) 120 cal/ °C e 0,12 cal g°C
Alternativa correta letra B) 80 cal/ °C e 0,16 cal g°C
A capacidade térmica C é a quantidade de calor (Q) necessária para variar a temperatura (T) de um corpo em uma unidade. A fórmula é:
C = Q / ΔT
O calor específico c é a quantidade de calor necessária para variar a temperatura de uma massa (m) de uma substância em uma unidade. A fórmula é:
c = Q / mΔT
Nesse caso, temos que Q = 4000 cal, m = 500 g e Δ = 70 °C – 20 °C = 50 °C. Substituindo esses valores nas fórmulas, temos:
C = 4000 / 50 = 80 cal/°C
c = 4000 / 500×50 = 0,16 cal/g°C
Portanto, a alternativa correta é a letra B.
137) (PUC-RIO 2010) Uma quantidade de água líquida de massa m = 200 g, a uma temperatura de 30 Cº, é colocada em um calorímetro junto a 150 g de gelo a 0 Cº. Após atingir o equilíbrio, dado que o calor específico da água é c = 1,0 cal/ (g.ºC), qual é a temperatura final do sistema?
- A) 0 Cº
- B) 10 Cº
- C) 20 Cº
- D) 30 Cº
- E) 40 Cº
A resposta correta é a alternativa A) 0 Cº.
Para resolver essa questão, podemos usar o princípio de conservação de energia. A energia térmica perdida pela água líquida deve ser igual à energia térmica ganha pelo gelo, mais a energia necessária para a mudança de fase do gelo para água líquida. Assim, temos:
Qperdido = Qganhado + Qfusão
Onde:
- Qperdido é a energia térmica perdida pela água líquida, dada por Qperdido = m⋅c⋅ΔT, onde m é a massa da água, c é o calor específico da água e ΔT é a variação de temperatura da água.
- Qganhado é a energia térmica ganha pelo gelo, dada por Qganhado = m′⋅c′⋅ΔT′, onde m′ é a massa do gelo, c′ é o calor específico do gelo e ΔT′ é a variação de temperatura do gelo.
- Qfusão é a energia necessária para a mudança de fase do gelo para água líquida, dada por Qfusão = m′⋅L, onde L é o calor latente de fusão do gelo.
Substituindo os valores dados no enunciado, temos:
200 ⋅ 1,0 ⋅ (30 − Tf) = 150 ⋅ 0,5⋅(Tf − 0) + 150 ⋅ 80
Onde Tf é a temperatura final do sistema. Resolvendo essa equação, obtemos:
Tf = 0
Portanto, a temperatura final do sistema é 0 Cº.
